Neovaskularisation/Angiogenese
![]()
PSI für Neovaskularisation/Angiogenese
Neovaskularisation bezeichnet die Bildung neuer mikrovaskulärer Netzwerke. In vivo lässt sich dieser Prozess vorrangig durch Angiogenese erzielen, d. h. durch das Aussprossen neuer Gefäße aus vorhandenen Gefäßen. Neovaskularisation/Angiogenese spielt bei vielen Therapien und Pathologien eine entscheidende Rolle, weshalb sie in vielen Bereichen auch so eingehend erforscht wird, wie z. B. in der Gewebezüchtung, der regenerativen Medizin, der vaskulären Biologie und der Krebsbiologie. Je nach Anwendung gibt es viele Modelle für die Entwicklung/Verabreichung von Medikamenten, die Charakterisierung von Krankheiten und die Stammzellenbehandlung. Es besteht Bedarf an Instrumenten, die zur Beurteilung der Bildung neuer Gefäße dienen können, vorzugsweise anhand nicht-invasiver und nicht-destruktiver Methoden. Mit dem PeriCam PSI Laser Speckle Contrast Imaging System kann man Veränderungen der mikrovaskulären Blutperfusion im Zeitverlauf nachverfolgen. Studien haben gezeigt, dass eine Zunahme der Perfusion mit der Bildung von funktionaleren Blutgefäßen einhergeht. Das PeriCam PSI kam bei mehreren dieser Modelle zum Einsatz.

(A) Foto der Rückenansicht und PSI Längsschnitte zur Perfusionsuntersuchung einer Maus mit zwei subkutanen Fibringerüst-Implantaten mit und ohne angiogenem Wachstumsfaktor. Die ROI wurden auf Grundlage der Implantatstellen ausgewählt. (B) Quantifizierung der Perfusionsveränderung bezüglich Tag 0, auf Grundlage einer ROI-Analyse der PSI Perfusionsbilder, zeigt eine allgemeine Zunahme der Perfusion im Zeitverlauf. Die größte Veränderung der Perfusion wurde an Tag 7 beobachtet, da die +bFGF-Gerüste zu einer stärkeren Perfusion tendierten als die -bFGF-Gerüste 1-2.
Abbildung mit freundlicher Genehmigung von Dr. Mario Fabiilli, aus LED-Based Photoacoustic Imaging for Monitoring Angiogenesis in Fibrin Scaffolds Autor: Yunhao Zhu, Xiaofang Lu, Xiaoxiao Dong, et al Veröffentlichung: Tissue Engineering Part C: Methods
Herausgeber: Mary Ann Liebert, Inc. Datum: 1. Sep 2019.
Übersicht
Das PeriCam PSI hat sich in verschiedenen Bereichen auf dem Forschungsgebiet der Neovaskularisation und Angiogenese als nützliches Werkzeug erwiesen. Ein Hauptfeld ist die Erforschung pro-angiogener Therapien für die periphere Arterienverschlusskrankheit und Wundheilung an präklinischen Tiermodellen. Zur Erforschung von pAVK, wird in einer unteren Gliedmaße eine Ischämie chirurgisch induziert und mit dem PeriCam PSI bestätigt. Mit dem Instrument lässt sich auch der dynamische Verlauf der Perfusionserholung im Zeitverlauf nachverfolgen. In einem ähnlichen Verfahren werden Hautwunden erzeugt und der normale Heilungsverlauf mit dem PeriCam PSI nachverfolgt. Bei beiden Modellen kann man dasselbe Versuchstier mit dem PeriCam PSI anhand von Längsschnitten überwachen, was Zeit und Geld einspart, da man so weniger Tiere für eine Studie benötigt.
Ein weiteres Feld ist die Krebsforschung, in der eine Verwendung in CAM-Assays, Modellen für subkutane Tumore sowie in der Entwicklung anti-angiogener Mittel zur Behandlung möglich ist. Mit dem PeriCam PSI lässt sich die Perfusion in den Tumoren während ihres Wachstums überwachen und die Wirksamkeit von Medikamenten bewerten, die die Tumore aushungern sollen.
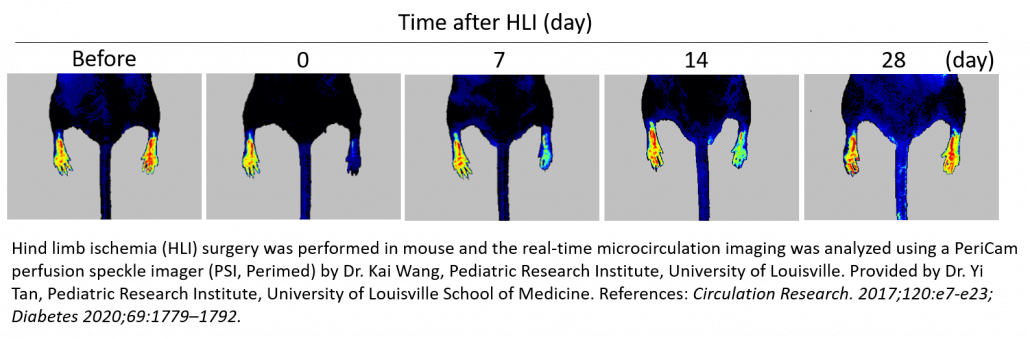
Hinterlauf-Ischämie (HLI)
Das Mausmodell für Hinterlauf-Ischämie ist wichtig für die Erforschung der peripheren Verschlusskrankheit und kommt hier häufig zum Einsatz. Dieses Modell umfasst die einseitige Ligatur und Exzision der Femurarterie, um eine akute Ischämie der Gliedmaße auszulösen. Anhand verschiedener Strategien, wie der Verabreichung von Wachstumsfaktoren und Zelltherapie, lässt sich nun die vaskuläre Regeneration, die Angiogenese und die Arteriogenese beurteilen. Es ist ebenso möglich, damit die pro-angiogene Wirkung von Therapeutika zu bewerten 3-12 oder die natürliche Genesung zwischen gesunden 13 und kranken (diabetischen) 14-16, jungen und alten 17 oder wilden und Knock-out-Tieren zu vergleichen 18-20.
Mit dem PeriCam PSI Laser Speckle Contrast Imaging System wird nach dem Eingriff das Vorhandensein von Ischämie geprüft, indem ein Nachlassen der Blutperfusion in der Mikrozirkulation gemessen (60-70 %) und im Längsschnitt die Wirksamkeit der Behandlungsstrategie überwacht wird. Normalerweise wird jedes Tier nach der Operation/Behandlung bis zu einen Monat lang mit dem PSI beobachtet, um die schrittweise Zunahme der Blutperfusion zu dokumentieren, die sich aus der Revaskularisierung ergibt. Dieses Vorgehen erspart Zeit und Geld, da die Anzahl der für eine Studie erforderlichen Tiere sinkt.
Assay der Chorioallantoismembran (CAM) des Huhns
Die CAM wird bei der Entstehung des Hühnerembryos gebildet und entsteht aus der Verschmelzung der mesodermalen Schicht der Allantois mit der mesodermalen Schicht des Chorions. Sie ist eine zusätzliche stark vaskularisierte und nicht-innervierte Embryomembran, die somit ein ideales Substrat zur Untersuchung von Gefäßneubildung und Tumorwachstum darstellt. Ein befruchtetes Hühnerei wird vier bis acht Tage lang inkubiert, dann wird in der Schale ein Fenster geschaffen, durch das die Bildung des Embryos und der Blutgefäße beobachtet wird.
Für das Angiogenese-Assay können verschiedene Biomoleküle und Medikamente topisch aufgetragen und ihre angiogene Wirkmächtigkeit untersucht werden. Es können auch Biomaterialgerüste implantiert und die Gefäßinvasion im Zeitverlauf überwacht werden, um eine Strategie zur Gewebezüchtung auszuwerten.
Für Krebsmodelle können verschiedene Krebszellen in die CAM transplantiert werden, um Tumorwachstum zu beobachten. So entsteht ein relativ simples Modell zur Untersuchung der Entstehung vieler verschiedener Krebstumore, anhand dessen sich neue Therapien und individualisierte Behandlungsstrategien testen lassen. Das CAM-Modell ermöglicht eine hohe Reproduzierbarkeit, ist kostengünstig und muss im Gegensatz zu vielen anderen in-vivo-Tiermodellen nicht von einem Ethikrat genehmigt werden. Außerdem besitzt das CAM-Modell eine natürliche Immunschwäche, weshalb es ideal für Zelltransplantate ist. Das geschlossene System verlängert die Halbwertzeit vieler experimenteller Moleküle, sodass für Studien eine geringere Menge benötigt wird.
Mit dem PeriCam PSI Laser Speckle Contrast Imaging System lassen sich im Angiogenese-Assay Veränderungen der Blutperfusion messen und Unterschiede in der Wirkweise verschiedener pro-angiogener Präparate feststellen. Es kann ebenso verwendet werden, um die Entstehung funktionaler intra-tumoraler Blutgefäße zu überwachen 25 und die Wirksamkeit von anti-angiogenen Mitteln zur Krebsbehandlung zu beurteilen.
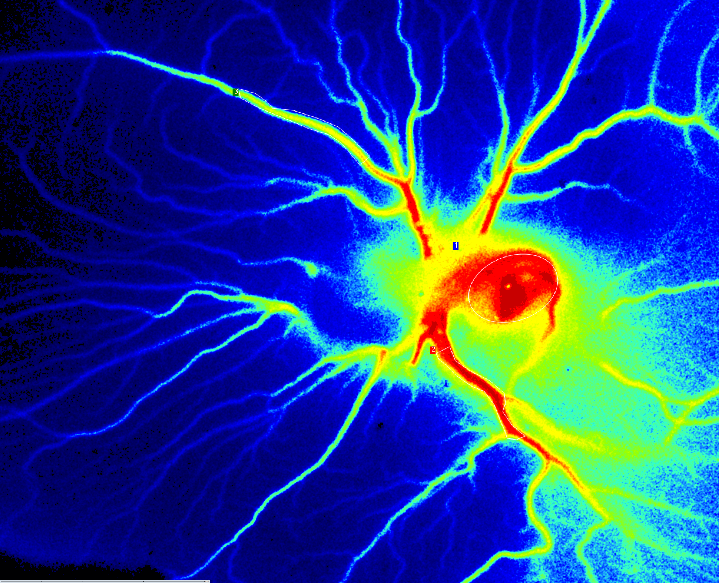
PSI Z Perfusion von CAM-Assay an Tag 6 nach der Befruchtung.
Subkutaner Tumor
Das Wachstum und die Metastasierung von Tumoren ist abhängig von der Entwicklung von Blutgefäßen und einer effektiven Mikrozirkulation. Ohne Angiogenese kann ein kleiner Tumorherd an einem sekundären Standort nicht wachsen. Da die Angiogenese beim Tumorwachstum, der Progression, der Invasion und der Metastasierung eine zentrale Rolle spielt, stellt ihre Hemmung eine mögliche Strategie für die Krebsbehandlung dar.
Das Modell für subkutane Tumore ist das am weitesten verbreitete System zur Bewertung der in-vivo-Entwicklung neuartiger Kandidaten für die Krebsmedizin. Üblicherweise kommen hierfür immungeschwächte Tierstämme zur Anwendung. Ihnen werden gezüchtete Krebszellen subkutan implantiert, aus denen in rund zwei Wochen ein fester Tumor entsteht. Eine große Zahl an menschlichen und Mäuse-Krebszelllinien wurden so angepasst, dass sie in Nagetieren wachsen können, um Therapeutika im jeweiligen Tumormodell bewerten zu können. Die Forscher überwachen das Wachstum und die Progression des Tumors und prüfen oft auch die Dichte an Mikrogefäßen, um die Wirksamkeit ihrer Behandlungsstrategie zu beurteilen. Mit dem PeriCam PSI lässt sich die Blutperfusion subkutaner Tumore im Zeitverlauf überwachen und die Wirksamkeit anti-angiogener Krebstherapien bewerten.
Perfusionsbilder eines Mäuseohrs mit subkutanem Tumor an Tag 14. Die Bilder zeigen eine Zunahme der Blutperfusion im Tumor als Reaktion auf einen Wärmereiz.
Referenzen:
1. LED-Based Photoacoustic Imaging for Monitoring Angiogenesis in Fibrin Scaffolds. Yunhao Zhu, Xiaofang Lu, Xiaoxiao Dong, Jie Yuan, Mario L. Fabiilli, and Xueding Wang. 9, September 2019, Tissue Engineering Part C: Methods, Vol. 25, pp. 523-531.
2. Controlled release of basic fibroblast growth factor for angiogenesis using acoustically-responsive scaffolds. Alexander Moncion, Melissa Lin, Eric G. O’Neill, Renny T. Franceschi, Oliver D. Kripfgans, Andrew J. Putnam, Mario L. Fabiilli. 2017, Biomaterials, Vol. 140, pp. 26-36.
3. MiR-15b-5p Regulates Collateral Artery Formation by Targeting AKT3 (Protein Kinase B-3). Ling-Ping Zhu, Ji-Peng Zhou, Jia-Xiong Zhang, Jun-Yao Wang, Zhen-Yu Wang, Miao Pan, Ling-. May 2017, Arteriosclerosis, Thrombosis, and Vascular Biology, Vol. 37, pp. 957-968.
4. Precise and long-term tracking of adipose-derived stem cells and their regenerative capacity via superb bright and stable organic nanodots. Dan Ding, Duo Mao, Kai Li, Xiaomin Wang, Wei Qin, Rongrong Liu, David Shunzhong Chiam, Nikodem Tomczak, Zhimou Yang, Ben Zhong Tang, Deling Kong, Bin Liu. 12, 2014, ACS Nano, Vol. 8, pp. 12620-12631.
5. Extracellular Matrix Hydrogel Promotes Tissue Remodeling, Arteriogenesis, and Perfusion in a Rat Hindlimb Ischemia Model. Jessica L. Ungerleider, Todd D. Johnson, Melissa J. Hernandez, Dean I. Elhag, Rebecca L. Braden, Monika Dzieciatkowska, Kent G. Osborn, Kirk C. Hansen, Ehtisham Mahmud and Karen L. Christman. 1-2, 2016, JACC: Basic to Translational Science, Vol. 1, pp. 32-44.
6. Engineering an Injectable Muscle-Specific Microenvironment for Improved Cell Delivery Using a Nanofibrous Extracellular Matrix Hydrogel. Nikhil Rao, Gillie Agmon, Matthew T. Tierney, Jessica L. Ungerleider, Rebecca L. Braden, Alessandra Sacco, Karen L. Christman. 2017, ACS Nano, Vol. 11, pp. 3851-3859.
7. Marrow-isolated adult multilineage inducible cells embedded within a biologically-inspired construct promote recovery in a mouse model of peripheral vascular disease. Cristina Grau-Monge, Gaëtan J-R Delcroix, Andrea Bonnin-Marquez, Mike Valdes, Ead Lewis Mazen Awadallah, Daniel F Quevedo, Maxime R Armour, Ramon B Montero, Paul C Schiller, Fotios M Andreopoulos and Gianluca D’Ippolito. 1, 2017, Biomedical Materials, Vol. 12, p. 015024.
8. Natural compound bavachalcone promotes the differentiation of endothelial progenitor cells and neovascularization through the RORα-erythropoietin-AMPK axis. Shuang Ling, Rong-Zhen Ni, Yunyun Yuan, Yan-Qi Dang, Qian-Mei Zhou, Shuang Liang, Fujiang Guo, Wei Feng, Yuanyuan Chen, Katsumi Ikeda, Yukio Yamori, and Jin-Wen Xu. 49, 2017, Oncotarget, Vol. 8, pp. 86188-86205.
9. Topical tissue nano-transfection mediates non-viral stroma reprogramming and rescue. Daniel Gallego-Perez, Durba Pal, Subhadip Ghatak, VeysiMalkoc, Natalia Higuita-Castro, Surya Gnyawali, Lingqian Chang, Wei-Ching Liao, Junfeng Shi, Mithun Sinha, Kanhaiya Singh, Erin teen, Alec Sunyecz, Richard Stewart, JordanMoore, Thomas Ziebro, Robert. 2017, Nature Nanotechnology, Vol. 12, pp. 974-979.
10. In vivo efficacy of endothelial growth medium stimulated mesenchymal stem cells derived from patients with critical limb ischemia. Rida Al-Rifai, Philippe Nguyen, Nicole Bouland, Christine Terryn, Lukshe Kanagaratnam, Gaël Poitevin, Caroline François, Catherine Boisson-Vidal, Marie-Antoinette Sevestre & Claire Tournois. 17, 2019, Journal of Translational Medicine, Vol. 9, p. 261.
11. NFAT5 promotes arteriogenesis via MCP‐1‐dependent monocyte recruitment. Zhang, Xing‐Chi Lin Miao Pan Ling‐Ping Zhu Quan Sun Zheng‐Shi Zhou Chuan‐Chang Li Guo‐Gang. 2, 2020, Journal of Cellular and Molecular Medicine, Vol. 24.
12. MicroRNA-146a Regulates Perfusion Recovery in Response to Arterial Occlusion via Arteriogenesis. Heuslein Joshua L., McDonnell Stephanie P., Song Ji, Annex Brian H., Price Richard J. 2018, Frontiers in Bioengineering and Biotechnology, Vol. 6, p. 1.
13. Denervation in Femoral Artery-Ligated Hindlimbs Diminishes Ischemic Recovery Primarily via Impaired Arteriogenesis. Yinghuan Cen, Junfeng Liu, Yuansen Qin, Ruiming Liu, Huijin Wang, Yu Zhou, Shenming Wang, Zuojun Hu. 5, 2016, PLOS One, Vol. 11, p. e0154941.
14. Elevating CXCR7 Improves Angiogenic Function of EPCs via Akt/GSK-3β/Fyn-Mediated Nrf2 Activation in Diabetic Limb Ischemia. Xiaozhen Dai, Xiaoqing Yan, Jun Zeng, Jing Chen, Yuehui Wang, Jun Chen, Yan Li, Michelle T Barati, Kupper A Wintergerst, Kejian Pan, Matthew A Nystoriak, Daniel J Conklin, Gregg Rokosh, Paul N Epstein, Xiaokun Li, Yi Tan. 2017, Circulation Research, Vol. 120, pp. e7-e23.
15. Sitagliptin-mediated preservation of endothelial progenitor cell function via augmenting autophagy enhances ischaemic angiogenesis in diabetes. Dai, X., Zeng, J., Yan, X., Lin, Q., Wang, K., Chen, J., Shen, F., Gu, X., Wang, Y., Chen, J., Pan, K., Cai, L., Wintergerst, K. A. and Tan, Y. 1, 2018, Journal of Cellular and Molecular Medicine, Vol. 22, pp. 89-100.
16. Endothelial Overexpression of Metallothionein Prevents Diabetes-Induced Impairment in Ischemia Angiogenesis Through Preservation of HIF-1α/SDF-1/VEGF Signaling in Endothelial Progenitor Cells. Kai Wang, Xiaozhen Dai, Junhong He, Xiaoqing Yan, Chengkui Yang, Xia Fan, Shiyue Sun, Jing Chen, Jianxiang Xu, Zhongbin Deng, Jiawei Fan, Xiaohuan Yuan, Hairong Liu, Edward C. Carlson, Feixia Shen, Kupper A. Wintergerst, Daniel J. Conklin, Paul N. Epstein. 8, August 2020, Diabetes, Vol. 69, pp. 1779-1792.
17. DNA Methyltransferase 1–Dependent DNA Hypermethylation Constrains Arteriogenesis by Augmenting Shear Stress Set Point. Joshua L. Heuslein, Catherine M. Gorick, Ji Song, Richard J. Price. 12, 2017, Journal of the American Heart Association, Vol. 6.
18. Loss of Endothelial CXCR7 Impairs Vascular Homeostasis and Cardiac Remodeling After Myocardial Infarction. Huifeng Hao, PhD, et al. 2017, Circulation, Vol. 135, pp. 1253-1264.
19. Vascular growth responses to chronic arterial occlusion are unaffected by myeloid specific focal adhesion kinase (FAK) deletion. Joshua L. Heuslein, Kelsey P. Murrell, Ryan J. Leiphart, Ryan A. Llewellyn, Joshua K. Meisner & Richard J. Price. 2016, Scientific Reports, Vol. 6, p. 27029.
20. Despite Normal Arteriogenic and Angiogenic Responses, Hindlimb Perfusion Recovery and Necrotic and Fibro-Adipose Tissue Clearance Are Impaired in MMP9 Deficient Mice. Meisner JK, Annex BH, Price RJ. 6, 2015, Journal of Vascular Surgery, Vol. 61, pp. 1583–1594.
21. Cutaneous Epithelial to Mesenchymal Transition Activator ZEB1 Regulates Wound Angiogenesis and Closure in a Glycemic Status–Dependent Manner. Singh, Kanhaiya and Sinha, Mithun and Pal, Durba and Tabasum, Saba and Gnyawali, Surya C. and Khona, Dolly and Sarkar, Subendu and Mohanty, Sujit K. and Soto-Gonzalez, Fidel and Khanna, Savita and Roy, Sashwati and Sen, Chandan K. 11, 2019, Diabetes, Vol. 68, pp. 2175-2190.
22. Correction of MFG-E8 Resolves Inflammation and Promotes Cutaneous Wound Healing in Diabetes. A. Das, S. Ghatak, M. Sinha, S. Chaffee, Noha S. Ahmed, N. L. Parinandi, E. S. Wohleb, J. F. Sheridan, C. K. Sen, and S. Roy. 12, 2016, The Journal of Immunology, Vol. 196, pp. 5089-5100.
23. Circulating Exosomal miR-20b-5p Inhibition Restores Wnt9b Signaling and Reverses Diabetes-Associated Impaired Wound Healing. Yuan Xiong, Lang Chen, Chenchen Yan, Wu Zhou, Yori Endo, Jing Liu, Liangcong Hu,Yiqiang Hu, Bobin Mi and Guohui Liu. 3, 2020, Small, Vol. 16, p. 1904044.
24. Saliva Exosomes-Derived UBE2O Promotes Angiogenesis in Cutaneous Wounds by Targeting SMAD6. Bobin Mi, Lang Chen, Yuan Xiong, Chenchen Yan, Hang Xue, Adriana C. Panay, Jing Liu, Liangcong Hu, Yiqiang Hu, Yun Sun, Faqi Cao, Wu Zhou, Guohui Liu. 18, 2020, Journal of Nanobiotechnology, Vol. 6, p. 68.
25. Laser speckle contrast analysis (LASCA) technology for the semiquantitative measurement of angiogenesis in in-ovo-tumor-model. Eric Pion, Claudia Asam, Anna-Lena Feder, Oliver Felthaus, Paul I. Heidekrueger,Lukas Prantl, Silke Haerteis, Thiha Aung. 2020, Microvascular Research, Vol. 133, p. 104072.
Füllen Sie das Formular aus, um mehr Informationen zu erhalten
Haftungsausschluss: Es ist möglich, dass die Produkte auf der Perimed-Website nicht in allen Märkten zum Verkauf freigegeben sind.




